جدول تناوبی عناصر به زبان ساده
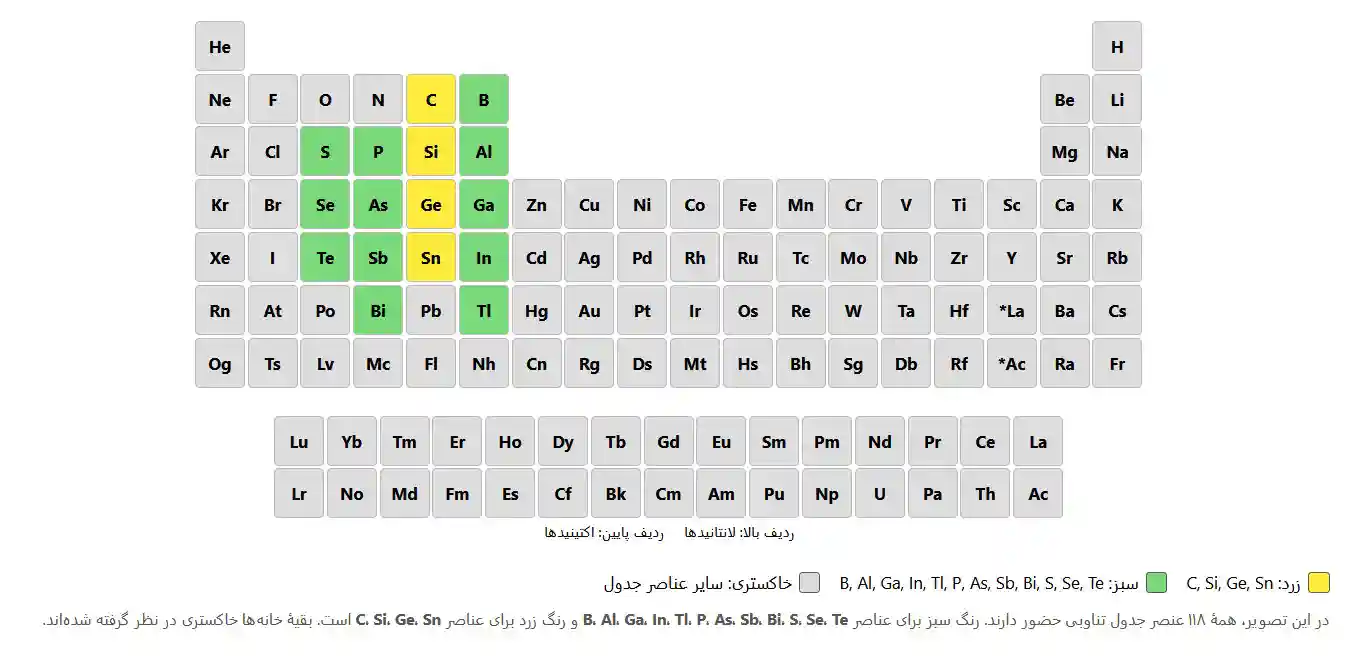
جدول تناوبی عناصر شیمیایی یکی از بنیادیترین دستاوردهای علم شیمی و از مهمترین ابزارهای شناخت ماده در جهان است. این جدول، عناصر شیمیایی شناختهشده را بر اساس نظم مشخصی که ریشه در ساختار اتمی آنها دارد، طبقهبندی میکند. جدول تناوبی نهتنها به درک بهتر خواص فیزیکی و شیمیایی عناصر کمک میکند، بلکه امکان پیشبینی رفتار آنها در واکنشهای شیمیایی را نیز فراهم میسازد. در این مقاله، تاریخچهٔ شکلگیری جدول تناوبی، ساختار آن، اصول علمی حاکم بر چینش عناصر، دستهبندی عناصر، روندهای تناوبی، کاربردها در علوم مختلف و اهمیت آن در زندگی روزمره بهطور کامل و با زبانی ساده بررسی میشود.
از دیرباز انسانها در تلاش بودهاند تا جهان پیرامون خود را بشناسند و مواد تشکیلدهندهٔ آن را درک کنند. هر آنچه در طبیعت وجود دارد، از سادهترین سنگها گرفته تا پیچیدهترین موجودات زنده، از واحدهای بنیادی به نام «اتم» ساخته شده است. اتمها با ترکیبهای گوناگون خود عناصر شیمیایی را پدید میآورند. امروزه بیش از ۱۱۸ عنصر شیمیایی شناخته شدهاند که هرکدام خواص منحصربهفردی دارند.
با افزایش تعداد عناصر کشفشده در قرن نوزدهم، دانشمندان دریافتند که برای مطالعه و استفادهٔ مؤثر از این عناصر، نیاز به یک نظام طبقهبندی منسجم وجود دارد. نتیجهٔ این تلاشها، شکلگیری جدول تناوبی عناصر بود؛ جدولی که نهتنها عناصر را مرتب میکند، بلکه رابطهٔ میان آنها را نیز آشکار میسازد.
مفهوم عنصر شیمیایی
عنصر شیمیایی به مادهای گفته میشود که از اتمهایی با عدد اتمی یکسان تشکیل شده است. عدد اتمی برابر با تعداد پروتونهای موجود در هستهٔ اتم است و این عدد هویت عنصر را تعیین میکند. برای مثال:
- تمام اتمهایی که یک پروتون دارند، عنصر هیدروژن هستند.
- تمام اتمهایی که شش پروتون دارند، عنصر کربن را تشکیل میدهند.
تفاوت عناصر با یکدیگر ناشی از تفاوت در ساختار اتمی، بهویژه در تعداد الکترونها و نحوهٔ آرایش آنها در اطراف هسته است.
تاریخچهٔ شکلگیری جدول تناوبی
طبقهبندیهای اولیه
پیش از تدوین جدول تناوبی مدرن، دانشمندان تلاشهای گوناگونی برای دستهبندی عناصر انجام دادند. برخی از این تلاشها عبارتاند از:
- سهتاییهای دوبراینر: در این روش، عناصر با خواص مشابه در گروههای سهتایی قرار میگرفتند.
- قانون اکتاوهای نیولندز: نیولندز مشاهده کرد که هر عنصر هشتم خواصی مشابه عنصر اول دارد.
اگرچه این روشها ناقص بودند، اما پایهای برای شکلگیری جدول تناوبی فراهم کردند.
مندلیف و تولد جدول تناوبی
در سال ۱۸۶۹، دیمیتری مندلیف، شیمیدان روسی، جدولی ارائه داد که عناصر را بر اساس جرم اتمی مرتب میکرد. او متوجه شد که خواص شیمیایی عناصر بهصورت تناوبی تکرار میشود. یکی از مهمترین ویژگیهای جدول مندلیف این بود که:
- برای عناصری که هنوز کشف نشده بودند، جا خالی گذاشت.
- خواص این عناصر ناشناخته را با دقت زیادی پیشبینی کرد.
پیشبینیهای مندلیف بعدها با کشف عناصری مانند گالیم و ژرمانیم تأیید شد.
اصلاح جدول بر اساس عدد اتمی
در اوایل قرن بیستم، هنری موزلی نشان داد که ترتیب عناصر باید بر اساس عدد اتمی و نه جرم اتمی باشد. این کشف باعث رفع ناهماهنگیهای جدول مندلیف شد و جدول تناوبی مدرن شکل گرفت.
ساختار جدول تناوبی
دورهها (Periods)
دورهها سطرهای افقی جدول تناوبی هستند. جدول تناوبی دارای ۷ دوره است. ویژگیهای مهم دورهها:
- هر دوره با یک فلز قلیایی آغاز میشود (بهجز دورهٔ اول).
- هر دوره با یک گاز نجیب پایان مییابد.
- با حرکت از چپ به راست، عدد اتمی افزایش مییابد.
گروهها (Groups)
گروهها ستونهای عمودی جدول تناوبی هستند و شامل ۱۸ گروه میشوند. عناصر هر گروه:
- تعداد الکترونهای لایهٔ ظرفیت یکسان دارند.
- خواص شیمیایی مشابهی از خود نشان میدهند.
آرایش الکترونی و ارتباط آن با جدول تناوبی
آرایش الکترونی نشاندهندهٔ نحوهٔ توزیع الکترونها در لایهها و زیرلایههای اطراف هسته است. ساختار جدول تناوبی مستقیماً با آرایش الکترونی عناصر مرتبط است. بهطور کلی:
- عدد دوره برابر با تعداد لایههای الکترونی است.
- عدد گروه (در عناصر اصلی) نشاندهندهٔ تعداد الکترونهای لایهٔ ظرفیت است.
بلوکهای جدول تناوبی
جدول تناوبی به چهار بلوک اصلی تقسیم میشود:
بلوک s
شامل گروههای ۱ و ۲ و عنصر هیدروژن و هلیوم است.
ویژگیها:
- عناصر بسیار واکنشپذیر
- اغلب فلزی
بلوک p
شامل گروههای ۱۳ تا ۱۸ است.
در این بلوک:
- فلزات، نافلزات و شبهفلزات وجود دارند.
- عناصر زیستی مهم مانند کربن، نیتروژن و اکسیژن قرار دارند.
بلوک d
شامل فلزات واسطه است.
ویژگیها:
- چندظرفیتی بودن
- نقش مهم در کاتالیزورها
بلوک f
شامل لانتانیدها و اکتینیدهاست.
این عناصر اغلب کمیاب و برخی رادیواکتیو هستند.
دستهبندی کلی عناصر
فلزات
بیش از ۷۵٪ عناصر را تشکیل میدهند.
خواص:
- رسانای خوب گرما و برق
- براق
- شکلپذیر
نافلزات
در سمت راست جدول قرار دارند.
خواص:
- رسانایی کم
- نقطه ذوب پایین
- نقش حیاتی در حیات
شبهفلزات
خواصی بین فلزات و نافلزات دارند.
کاربرد مهم در صنعت الکترونیک دارند.
روندهای تناوبی در جدول تناوبی
شعاع اتمی
- در یک دوره کاهش مییابد.
- در یک گروه افزایش مییابد.
انرژی یونش
- در یک دوره افزایش مییابد.
- در یک گروه کاهش مییابد.
الکترونگاتیوی
- نشاندهندهٔ تمایل اتم به جذب الکترون
- فلوئور بیشترین الکترونگاتیوی را دارد.
عناصر مهم و نقش آنها در زندگی
هیدروژن
- سادهترین عنصر
- منبع بالقوهٔ انرژی پاک
کربن
- پایهٔ شیمی آلی
- اساس حیات
اکسیژن
- ضروری برای تنفس
- نقش کلیدی در واکنشهای شیمیایی
آهن
- عنصر حیاتی در صنعت و بدن انسان
نحوهٔ خواندن جدول تناوبی عناصر
خواندن جدول تناوبی یعنی بتوانیم از روی جایگاه هر عنصر، اطلاعات مهم آن را سریع و درست برداشت کنیم. در ادامه، این کار را مرحلهبهمرحله و به زبان ساده توضیح میدهم.
۱. هر خانهٔ جدول تناوبی را چگونه بخوانیم؟
هر عنصر در جدول تناوبی داخل یک «خانه» قرار دارد. این خانه معمولاً شامل اطلاعات زیر است:
-
عدد اتمی (بالای خانه)
-
تعداد پروتونها (و در اتم خنثی، تعداد الکترونها)
-
مهمترین عدد برای شناسایی عنصر
-
-
نماد شیمیایی (وسط خانه)
-
یک یا دو حرف لاتین
-
حرف اول همیشه بزرگ است (مثلاً: H ، Na ، Fe)
-
-
نام عنصر
-
معمولاً زیر نماد نوشته میشود
-
-
جرم اتمی
-
میانگین جرم اتمهای عنصر
-
در محاسبات شیمیایی کاربرد دارد
-
🔹 مثال:
اگر عدد اتمی = 8 باشد → عنصر اکسیژن است.
۲. خواندن جدول از روی سطرها (دورهها)
سطرهای افقی جدول را دوره مینامند.
نکات مهم دربارهٔ دورهها:
-
جدول دارای ۷ دوره است
-
شمارهٔ دوره = تعداد لایههای الکترونی اتم
-
با حرکت از چپ به راست:
-
عدد اتمی افزایش مییابد
-
خواص عناصر بهتدریج تغییر میکند
-
🔹 مثال:
عناصر دورهٔ سوم (Na تا Ar) → همگی ۳ لایهٔ الکترونی دارند.
۳. خواندن جدول از روی ستونها (گروهها)
ستونهای عمودی جدول را گروه میگویند.
نکات مهم دربارهٔ گروهها:
-
جدول دارای ۱۸ گروه است
-
عناصر یک گروه:
-
تعداد الکترونهای لایهٔ ظرفیت یکسان دارند
-
رفتار شیمیایی مشابهی دارند
-
🔹 مثال:
-
گروه ۱ → فلزات قلیایی (بسیار واکنشپذیر)
-
گروه ۱۸ → گازهای نجیب (تقریباً بیواکنش)
۴. تشخیص نوع عنصر از روی جایگاه آن
۴.۱. فلزات
-
سمت چپ و وسط جدول
-
براق، رسانا، شکلپذیر
۴.۲. نافلزات
-
سمت راست جدول
-
اغلب گاز یا جامد شکننده
۴.۳. شبهفلزات
-
روی خط زیگزاگی بین فلزات و نافلزات
-
خواصی بین این دو دارند
۵. خواندن بلوکهای جدول تناوبی
جدول به چهار بلوک الکترونی تقسیم میشود:
🔹 بلوک s
-
گروههای ۱ و ۲
-
واکنشپذیری بالا
🔹 بلوک p
-
گروههای ۱۳ تا ۱۸
-
شامل عناصر مهم زیستی
🔹 بلوک d
-
فلزات واسطه
-
کاربرد صنعتی زیاد
🔹 بلوک f
-
لانتانیدها و اکتینیدها
-
اغلب عناصر کمیاب یا رادیواکتیو
۶. پیشبینی خواص عناصر با خواندن جدول
با خواندن درست جدول میتوان فهمید:
-
عنصر فلز است یا نافلز
-
چقدر واکنشپذیر است
-
چند الکترون ظرفیت دارد
-
تمایل به از دست دادن یا گرفتن الکترون دارد
🔹 مثال:
-
عناصر گوشهٔ چپ بالا → بسیار واکنشپذیر
-
عناصر گوشهٔ راست بالا → الکترونگاتیوی بالا
۷. یک روش سریع برای خواندن جدول (خلاصه)
وقتی عنصری را دیدی، این ۵ سؤال را بپرس:
-
عدد اتمی آن چیست؟
-
در کدام دوره است؟ (تعداد لایهها)
-
در کدام گروه است؟ (الکترون ظرفیت)
-
فلز است یا نافلز؟
-
واکنشپذیری آن کم است یا زیاد؟
کاربردهای جدول تناوبی
در آموزش
پایهٔ اصلی آموزش شیمی در مدارس و دانشگاههاست.
در صنعت
- تولید آلیاژها
- صنایع دارویی
- الکترونیک و نانوفناوری
در پزشکی
- رادیوداروها
- تجهیزات پزشکی
جدول تناوبی و آیندهٔ علم
با کشف عناصر مصنوعی جدید و پژوهش در فیزیک هستهای، جدول تناوبی همچنان در حال گسترش است. دانشمندان بهدنبال یافتن عناصر پایدارتر و بررسی خواص آنها هستند.
جدول تناوبی عناصر فارسی pdf با کیفیت بالا
نتیجهگیری
جدول تناوبی عناصر یک شاهکار علمی است که نظم پنهان دنیای ماده را آشکار میکند. این جدول نهتنها ابزار طبقهبندی عناصر است، بلکه زبانی مشترک برای درک ساختار جهان محسوب میشود. آشنایی عمیق با جدول تناوبی، دروازهای به فهم بهتر علم، فناوری و حتی حیات است.
نام عناصر جدول تناوبی به فارسی
عناصر اصلی جدول تناوبی
جدول تناوبی عناصر فارسی با کیفیت بالا
جدول تناوبی عناصر فارسی pdf
جدول مندلیف pdf
نام لاتین عناصر جدول تناوبی
جدول مندلیف کامل
جدول تناوبی با عناصر واقعی


 چراغ مطالعه
چراغ مطالعه چراغ اضطراری و شارژی
چراغ اضطراری و شارژی


 پنکه و کولر
پنکه و کولر تجهیزات دوربین مداربسته
تجهیزات دوربین مداربسته
 پارسانور
پارسانور کابل سازان یزد
کابل سازان یزد خراسان افشار نژاد
خراسان افشار نژاد شیرکوه یزد
شیرکوه یزد سارا
سارا پارسه شید (کملیون)
پارسه شید (کملیون) آمل سوکا
آمل سوکا بهین تاب
بهین تاب همدان ترانس
همدان ترانس ویداسی
ویداسی سیمیا
سیمیا کملیون
کملیون پارس شعاع توس
پارس شعاع توس پارس خزر
پارس خزر پارس شهاب
پارس شهاب پارس فانال
پارس فانال خیام الکتریک
خیام الکتریک دمنده
دمنده مازی نور
مازی نور نوسان
نوسان



