آشنایی با انواع باتریها | بررسی فنی، ساختار، تاریخچه و فناوریهای نوین

مقدمه
باتریها یکی از بنیادیترین اجزای سامانههای الکتریکی و الکترونیکی مدرن محسوب میشوند.
از تلفن همراه و لپتاپ گرفته تا خودروهای برقی و سامانههای خورشیدی، همه و همه متکی به وجود منبعی قابلاعتماد، سبک و پایدار برای ذخیرهی انرژی الکتریکی هستند.
باتریها در واقع تبدیلکنندهی انرژی شیمیایی به انرژی الکتریکی هستند که از طریق واکنشهای اکسایش و کاهش (Redox) درون سلولهای خود، جریان الکتریکی تولید میکنند.
از زمان اختراع نخستین سلول گالوانی در قرن نوزدهم تا امروز، پیشرفت فناوری باتریها یکی از محرکهای اصلی توسعهی علم برق و الکترونیک بوده است.
در ادامه بهصورت جامع، علمی و سئومحور به بررسی تاریخچه، ساختار، دستهبندی و فناوریهای مدرن باتریها میپردازیم.
تاریخچهی پیدایش و تحول باتریها
🔹 باتری اولیه: سلول ولتایی
مبدأ اختراع باتری به سال ۱۸۰۰ میلادی بازمیگردد، زمانی که آلساندرو ولتا (Alessandro Volta) دانشمند ایتالیایی، نخستین سلول الکتروشیمیایی را معرفی کرد.
او با قرار دادن صفحات روی و مس درون محلول نمکی، موفق شد اختلاف پتانسیلی تولید کند که میتوانست جریان پیوسته ایجاد نماید. این پدیده به نام پیل ولتایی (Voltaic Pile) شناخته شد.
بهافتخار او، واحد اندازهگیری ولتاژ نیز ولت (Volt) نامگذاری شد.
توسعهی سلولهای گالوانی
پس از آن، جان فردریک دنیل (Daniell) در سال ۱۸۳۶ سلولی طراحی کرد که با کاهش پلاریزاسیون الکترود، پایداری جریان را بهبود بخشید.
سلول دنیل در حقیقت نخستین باتری قابلاعتماد برای کاربردهای عملی تلگراف و مخابرات بود.
دوران مدرن
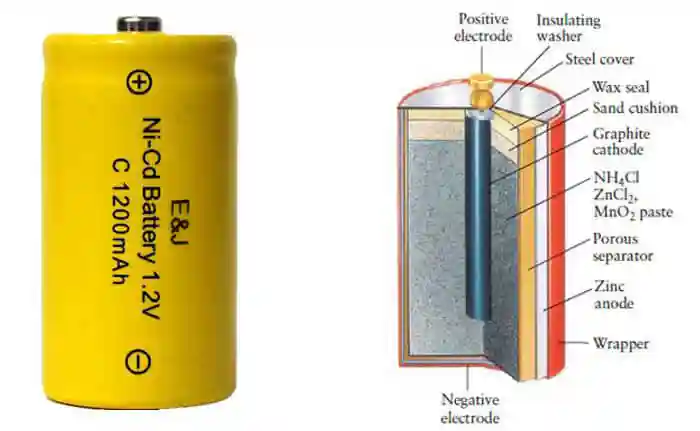
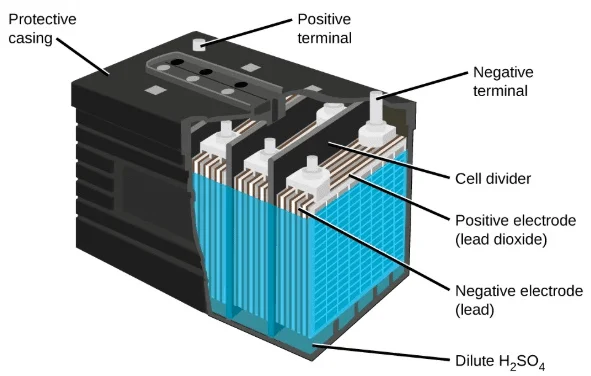
در قرن بیستم، باتریهای قابل شارژ نظیر سرب–اسیدی (برای خودروها) و نیکل–کادمیم (Ni–Cd) معرفی شدند.
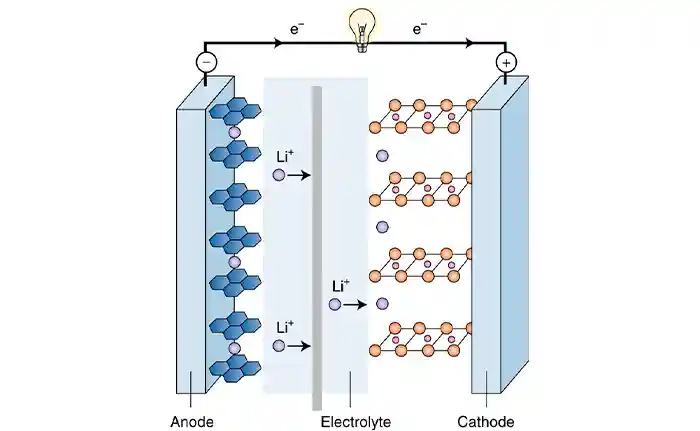
اما جهش واقعی در فناوری ذخیرهسازی انرژی با اختراع باتری لیتیوم-یون (Li-ion) در دههی ۱۹۹۰ میلادی رخ داد، که زمینهساز عصر موبایل و الکترونیک قابل حمل شد.
اصول عملکرد و ساختار باتری
باتریها از یک یا چند سلول الکتروشیمیایی تشکیل میشوند. هر سلول شامل اجزای زیر است:
| جزء | توضیح فنی |
|---|---|
| آند (Anode) | الکترودی که در آن واکنش اکسایش (از دست دادن الکترون) انجام میشود. در هنگام دشارژ، منبع الکترون است. |
| کاتد (Cathode) | الکترودی که در آن واکنش کاهش (دریافت الکترون) رخ میدهد. در هنگام دشارژ، مصرفکنندهی الکترون است. |
| الکترولیت (Electrolyte) | محیطی رسانا که انتقال یونها بین آند و کاتد را ممکن میسازد. میتواند مایع، ژل یا جامد باشد. |
| جداکننده (Separator) | غشایی نازک برای جلوگیری از تماس مستقیم الکترودها و وقوع اتصال کوتاه. |
| محفظه و پایانهها | پوشش مکانیکی برای حفاظت، و دو ترمینال مثبت و منفی جهت اتصال مدار خارجی. |
واکنش الکتروشیمیایی در باتری
در زمان تخلیه (Discharge)، الکترونها از آند آزاد شده و از طریق مدار خارجی به سمت کاتد حرکت میکنند، در حالی که یونها از طریق الکترولیت درون سلول جابهجا میشوند.
در هنگام شارژ (Charge)، جریان الکتریکی اعمالشده باعث انجام واکنش معکوس شده و یونها به مواضع اولیه بازمیگردند.این چرخهی برگشتپذیر است که امکان شارژ مجدد باتریهای قابلشارژ را فراهم میکند.
طبقهبندی باتریها از دیدگاههای مختلف
باتریها را میتوان از جنبههای گوناگون دستهبندی کرد: از نوع واکنش شیمیایی گرفته تا ساختار فیزیکی و قابلیت شارژ.
در ادامه، مهمترین دستهبندیها را بررسی میکنیم.
۱. بر اساس قابلیت شارژ
| نوع باتری | ویژگیها | مثالها |
|---|---|---|
| باتری اولیه (Primary) | غیرقابل شارژ، پس از تخلیه باید تعویض شود | باتری قلمی آلکالاین، سلول لیتیوم غیرقابل شارژ |
| باتری ثانویه (Secondary) | قابل شارژ با عبور جریان معکوس | باتری سرب–اسید، نیکل–کادمیم، لیتیوم–یون |
۲. بر اساس نوع الکترولیت
| نوع الکترولیت | ویژگیها | مثال |
|---|---|---|
| مایع | رسانایی بالا، اما احتمال نشت | باتری سرب–اسیدی |
| ژل | ایمنی بالاتر، قابلیت نصب در هر وضعیت | باتری ژلهای (Gel Battery) |
| جامد | در فناوریهای جدید برای افزایش چگالی انرژی و ایمنی استفاده میشود | باتری حالتجامد (Solid-State Battery) |
۳. بر اساس نوع واکنش شیمیایی
| نوع واکنش | توضیح | نمونه |
|---|---|---|
| سرب–اسید (Pb–acid) | واکنش بین سرب و دیاکسید سرب در محیط اسید سولفوریک | باتری خودرو |
| نیکل–کادمیم (Ni–Cd) | واکنش بین نیکل اکسید و کادمیم در محلول قلیایی | ابزار صنعتی |
| نیکل–متال هیدرید (Ni–MH) | جایگزین زیستمحیطیتر برای Ni–Cd | وسایل قابلحمل |
| لیتیوم–یون (Li–ion) | انتقال یونهای لیتیوم بین الکترودها | موبایل و لپتاپ |
| لیتیوم–پلیمر (Li–Po) | مشابه Li-ion ولی با الکترولیت پلیمری | گوشیهای هوشمند مدرن |
| سوختی (Fuel Cell) | تبدیل انرژی شیمیایی سوخت مانند هیدروژن به برق | خودروهای برقی هیدروژنی |
۴. بر اساس شکل و طراحی فیزیکی
| نوع طراحی | توضیح |
|---|---|
| استوانهای (Cylindrical) | شکل رایج در باتریهای AA و 18650 |
| مکعبی (Prismatic) | طراحی فشرده برای لپتاپها و خودروها |
| کیسهای (Pouch) | انعطافپذیر و سبک، معمول در گوشیها و پهپادها |
۵. بر اساس کاربرد
| حوزهی کاربرد | نوع باتری رایج |
|---|---|
| الکترونیک مصرفی | Li-ion، Li-Po، Ni-MH |
| خودرو و حملونقل | Pb–acid، Li-ion، LiFePO₄ |
| انرژیهای تجدیدپذیر (خورشیدی، بادی) | Gel، LiFePO₄ |
| کاربردهای نظامی و فضایی | Li-S، Li-metal، Solid-State |
مقایسهی کلی باتریهای اولیه و ثانویه
| ویژگی | باتری اولیه | باتری ثانویه |
|---|---|---|
| قابلیت شارژ | ندارد | دارد |
| هزینهی اولیه | کم | بیشتر |
| طول عمر | محدود به یک بار مصرف | چند صد تا چند هزار چرخه |
| راندمان انرژی | بالا در استفادهی اولیه | وابسته به نوع سلول |
| کاربرد | ریموت، ساعت، تجهیزات اضطراری | تلفن همراه، خودرو، UPS |
راندمان باتریهای ثانویه در چرخههای شارژ متعدد به شدت وابسته به پایداری ساختار الکترودها و پدیدهی دندریتسازی (Dendrite formation) است که میتواند منجر به اتصال کوتاه داخلی شود؛ یکی از چالشهای اصلی مهندسی باتریهای لیتیومی.
انواع باتری
باتری لیتیومی
ساختار باتری
تاریخچه باتری
فناوری باتری
انواع باتری ها و کاربردشان
عکس انواع باتری
انواع باتری با اسم
انواع باتری قابل شارژ
انواع باتری را نام ببرید علوم چهارم
انواع باتری چه تفاوتی با هم دارند علوم ششم


 چراغ مطالعه
چراغ مطالعه چراغ اضطراری و شارژی
چراغ اضطراری و شارژی


 پنکه و کولر
پنکه و کولر تجهیزات دوربین مداربسته
تجهیزات دوربین مداربسته

 پارسانور
پارسانور کابل سازان یزد
کابل سازان یزد خراسان افشار نژاد
خراسان افشار نژاد شیرکوه یزد
شیرکوه یزد سارا
سارا پارسه شید (کملیون)
پارسه شید (کملیون) آمل سوکا
آمل سوکا بهین تاب
بهین تاب همدان ترانس
همدان ترانس ویداسی
ویداسی سیمیا
سیمیا کملیون
کملیون پارس شعاع توس
پارس شعاع توس پارس خزر
پارس خزر پارس شهاب
پارس شهاب پارس فانال
پارس فانال خیام الکتریک
خیام الکتریک دمنده
دمنده مازی نور
مازی نور نوسان
نوسان



